pharmastarter
Grundlagen der Arzneimittelzulassung in der EU
Willkommen
Wie dieser Kurs funktioniert
Grundlegende Konzepte
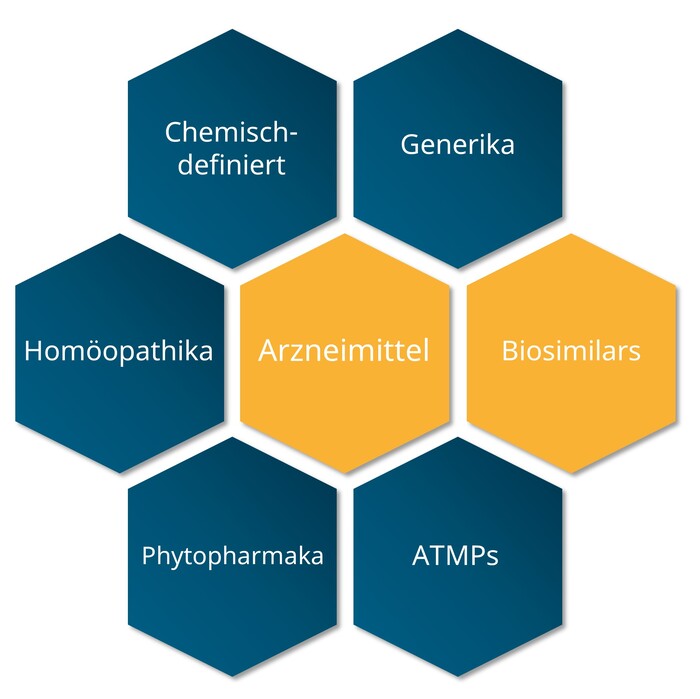
Arzneimittel
Wie entsteht ein neues Arzneimittel?
Zulassung von Arzneimitteln
Nach der Zulassung
Pharmakovigilanz
Abschluss-Quiz
Ende
Biologika & Biosimilars

Somatotropin (3D-Bänder-Struktur von Somatotropin aus der PDB, 1HGU).
Somatotropin ist der Wirkstoff des biologischen Arzneimittels "Genotropin" und dessen Biosimilar "Omnitrope", das 2006 in der EU zugelassen worden ist.

Biologika & Biosimilars
Was sind Biologika?
Biologische Arzneimittel, auch Biologika genannt, sind Arzneimittel, die Wirkstoffe aus biologischen Quellen enthalten. Beispielsweise Proteine aus gentechnisch veränderten Säugetierzellen.
Wirkstoffe von Biologika zeichnen sich darüber hinaus durch ihre Größe und ihre komplexe Molekülstruktur aus. Bei chemisch-synthetischen Arzneimitteln sind die Wirkstoffe dagegen meist viel kleiner und die chemische Formel des Wirkstoffs kann klar beschrieben werden. Die Herstellung von Biologika erfolgt in der Regel biotechnologisch.
Biologika werden häufig bei onkologischen Erkrankungen eingesetzt.
Beispiele biologischer Arzneimittel:
Wirkstoffe von Biologika zeichnen sich darüber hinaus durch ihre Größe und ihre komplexe Molekülstruktur aus. Bei chemisch-synthetischen Arzneimitteln sind die Wirkstoffe dagegen meist viel kleiner und die chemische Formel des Wirkstoffs kann klar beschrieben werden. Die Herstellung von Biologika erfolgt in der Regel biotechnologisch.
Biologika werden häufig bei onkologischen Erkrankungen eingesetzt.
Beispiele biologischer Arzneimittel:
- Insulin
- Impfstoffe
- Antikörper
- Wachstumshormone


Somatotropin (3D-Bänder-Struktur von Somatotropin aus der PDB, 1HGU).
Somatotropin ist der Wirkstoff des biologischen Arzneimittels "Genotropin" und dessen Biosimilar "Omnitrope", das 2006 in der EU zugelassen worden ist.
Biosimilars - ähnlich, aber nicht identisch
Biosimilars sind biologische Arzneimittel, die so entwickelt wurden, dass sie einem bereits zugelassenen biologischen Arzneimittel in allen wesentlichen Aspekten sehr ähnlich sind (in Bezug auf Struktur, Immunogenitätsprofil, Wirksamkeit, Qualität und Unbedenklichkeit). Das bereits zugelassene biologische Arzneimittel wird als Referenzprodukt bezeichnet.
Biosimilars sind biologische Arzneimittel, die so entwickelt wurden, dass sie einem bereits zugelassenen biologischen Arzneimittel in allen wesentlichen Aspekten sehr ähnlich sind (in Bezug auf Struktur, Immunogenitätsprofil, Wirksamkeit, Qualität und Unbedenklichkeit). Das bereits zugelassene biologische Arzneimittel wird als Referenzprodukt bezeichnet.
Aufgrund ihrer Komplexität werden Biosimilars regulatorisch aber anders als Generika behandelt. Da Biologika aus lebenden Organismen gewonnen werden, lassen sich über verschiedene Herstellverfahren keine identischen Produkte herstellen. Der Nachweis der Bioäquivalenz ist daher für Biosimilars nicht ausreichend. Stattdessen müssen zusätzliche Vergleichbarkeitsstudien durchgeführt werden, um zu zeigen, dass kleinere Abweichungen keinen Einfluss auf Unbedenklichkeit und Wirksamkeit haben. Die EMA bietet für die Entwicklung von Biosimilars wissenschaftliche Beratungsgespräche an, in denen sich auf die durchzuführenden Studien verständigt wird.
Biosimilars dürfen, wie Generika, erst nach Ablauf des Vermarktungsschutzes des EU-Referenzprodukts von 10 Jahren auf den Markt gebracht werden. Das erste Biosimilar in der EU wurde im Jahr 2006 zugelassen.